ASTM E1053方法概述
ASTM E1053:硬质表面消毒剂的杀菌效果-柱状中和
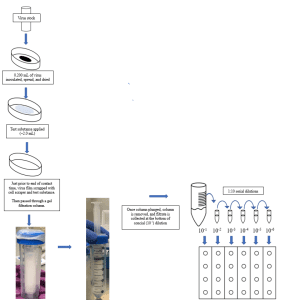
病毒制备及载体接种:
- 100 x 15毫米的培养皿用于液体和喷雾产品,150 x 20毫米的玻璃培养皿用于毛巾。
- 就在载体接种之前,测试病毒通过融化和必要时稀释到主办方要求的有机土壤负载(如果适用)的适当浓度来制备。
- 对于打算作为一步消毒剂销售的产品,EPA要求有机土壤负荷为5%的一步消毒剂声明。
- 带菌者接种,接种物使用无菌弯曲移液管尖端进行传播。
- 接种载体在适当的温度和湿度下干燥,以供测试病毒使用。
病毒对测试系统的暴露:
- 如果测试物质是喷雾产品,申请将按照赞助商要求的喷雾数量、距离和角度进行。
- 如果所述测试物质是液体产品,则将所述测试物质的混合物应用于所述干燥病毒膜。
- 如果测试物质是毛巾,则适当折叠擦拭,并将其擦过病毒膜。通过次数由研究主办方在测试前确定。
中和/传染性试验:
- 就在接触时间之前,通过刮擦载体底部来重新悬浮测试病毒膜。将重悬的病毒和测试物质吸入并通过所制备的凝胶过滤柱。
- 如果认为中和是一个问题,则可能需要单独使用化学中和剂或将化学中和剂和凝胶过滤柱结合使用。
- 稀释剂和/或滤液然后在测试介质中进行连续10倍稀释。然后将这些稀释剂接种到准备好的24孔板中。
有效测定的对照:
- 细胞培养控制-在所制备的24孔板中至少有4孔未接种任何病毒或测试物质以作为细胞培养控制。这证实了细胞在整个潜伏期内未被污染。
- 病毒滴度控制-大量的原液病毒经过连续10倍稀释。稀释剂接种于准备好的24孔板中,一式四份。这证实了所使用的细胞系对测试病毒既敏感又允许。
- 平板恢复控制-此控制与测试载体并行执行。将试验中使用的同一类型的载体用于平板恢复控制,并且以与测试载体相同的方式将载体接种病毒接种物。在病毒完全干燥后,通过添加测试介质和刮除载体使病毒重悬。所述病毒/介质液体通过所制备的凝胶过滤柱。滤液经过连续10倍稀释。这些稀释剂接种到24个孔板中。此控件用于确定乘积的对数约简。
- 细胞毒性控制-测试物质直接应用于适当数量的载体。在接触时间结束时,对载体施加相同的测试介质或适当的化学中和剂。载体的底部被刮过并通过凝胶过滤柱。将该滤液稀释并接种到准备好的24个孔板中。该控制验证测试物质对宿主细胞系无害(细胞毒性)。
- 在本对照中采用有效中和方法。
- 测试物质中和控制-这种控制是通过将测试物质应用到适当数量的载体上,并用测试介质或适当的化学中和剂收集物质来实现的。一旦通过凝胶过滤柱,滤液被稀释,每次稀释都用低滴度病毒进行挑战。接种稀释管至少保持接触时间,然后镀入准备好的24孔板。此控件验证测试物质已正确中和。
- 在本对照中采用有效中和方法。
在EPA看来,杀灭病毒的权利要求被认为是额外的权利要求,并且要求在杀灭病毒的权利要求之前或同时提交细菌基础权利要求。根据美国环保署的指导方针,公司想要声称的任何抗病毒声明都必须进行测试。测试需要两个独特批次的产品,最难灭活的病毒株必须用按认证下限(LCL)制备的批次进行测试。EPA批准提交的方法是ASTM E1053,可以对毛巾,喷雾和或液体产品进行修改。EPA对成功产品的要求是对数降低≥3.00对数10这意味着减少≥99.9%
杀毒功效成功标准
- 至少4.8-log10每个携带者的感染单元必须从病毒恢复控制中恢复。
- 测试产品显示在所有稀释度下测试病毒完全失活,或者,
- 如果中和后的检测产品在检测中产生细胞毒性,则3-log10还原超过观察到的细胞毒性水平。
- 中和对照表明所选择的中和方法是成功的-通常是通过相对于对照的相似水平的细胞病变效应的演示。
ASTM E1053方法的强度
- 生成的数据将符合美国环保署关于消毒剂声明所需功效数据的指南。
- 干燥的病毒片带来了重大挑战,提供了“最坏情况”的数据。
- 测试方法可以修改,以适应不同类型的测试产品应用(喷雾,擦拭,使用稀释)和不同的使用条件(脏的表面,不同的温度和湿度)。
ASTM E1053方法的弱点
- 针对坚硬无孔表面干燥病毒膜的配方所产生的数据可能无法转化为在悬浮液或其他应用中对病毒的功效。
- 检测限度可能受到细胞毒性和恢复介质体积的影响,需要使用更高的病毒滴度,这对测试产品提出了额外的挑战。
- 提交给美国环保署的数据对于其他国家的监管机构来说可能还不够。
根据美国EPA和FDA标准的ASTM E1053病毒表面时间杀伤测试可以在Microchem实验室作为简单的筛选(非GLP)和更全面的GLP研究条件下进行。2022足球世界杯32强
